Università Victoria di Manchester, 1909
 |
| Ernest Rutherford |
“Abbiamo
sparato una cannonata su una montagna di zucchero filato…”
“E quindi?”
“La palla di
cannone è rimbalzata indietro!”
Questo è il buffo dialogo che ho immaginato fra il grande fisico neozelandese Ernest Rutherford e i suoi assistenti Geiger e Mardsen, dopo gli esperimenti che questi avevano eseguito con lamine d’oro e particelle alfa. In ogni caso non credo che la discussione sia stata troppo diversa da questa, considerando quanto sorprendenti dovessero sembrare ai loro occhi i risultati di quegli esperimenti! ;-P
Ma, come al solito, facciamo prima un passo indietro: per capire con cosa stessero “giocando” i tre scienziati e perché i risultati che avevano ottenuto fossero così importanti, dobbiamo partire alla scoperta dei mattoncini che compongono tutta la materia.
L’esistenza degli atomi era nota già dagli inizi del XIX secolo, grazie principalmente alle teorie di John Dalton (quello del daltonismo). Egli aveva capito che le differenze fra le varie sostanze che osserviamo sono determinate da un numero finito (oggi ne conosciamo 118, all’epoca meno della metà) di tipi diversi di elementi e dalle varie combinazioni con cui questi possono mescolarsi fra loro. Riprendendo le idee di alcuni grandi filosofi della Grecia antica, fra i quali in particolare Democrito, Dalton chiamò queste “palline” appunto atomi: a-tomi, cioè “indivisibili” in greco.
Man mano che nuovi elementi chimici venivano scoperti, numerosi scienziati provarono a classificarli, a trovare dei criteri che potessero mettere ordine nella loro diversità. La soluzione più brillante della questione arrivò alla fine degli anni 1860, quando il chimico russo Dimitrij Ivanovic Mendeleev sviluppò la celeberrima tavola periodica degli elementi, con la quale si riusciva addirittura a prevedere alcune proprietà di elementi non ancora scoperti! Essa costituisce tutt’oggi, seppure aggiornata e con qualche modifica, una fondamentale mappa per orientarsi fra gli elementi, della quale nessun chimico può fare a meno!
A fine secolo, precisamente nel 1896, la scoperta della radioattività da parte del fisico e ingegnere francese Antoine Henri Becquerel dimostrò che questi atomi proprio indivisibili in realtà non lo fossero, aprendo la strada allo studio della loro struttura interna.
Diversi e anche fantasiosi furono i modelli ipotizzati, a partire da quello “a panettone” del fisico inglese Joseph John Thomson: dal momento che la materia che osserviamo è in genere elettricamente neutra, dentro agli atomi dovevano per forza di cose esserci delle cariche elettriche positive che compensassero quelle negative degli elettroni, particelle sub-atomiche scoperte pochi anni prima con carica appunto negativa. L’idea fondamentale di Thomson era che gli elettroni si trovassero sparsi qua e là all’interno di una nuvola carica positivamente, proprio come l’uvetta nel panettone! In questo modo l’atomo assumeva la forma di una sferetta piena, cioè senza alcuno spazio vuoto al suo interno.
Fu poi la volta del fisico giapponese Nagaoka Hantarō, il quale ipotizzò un modello atomico “saturniano”, con le cariche positive al centro (la prima idea di nucleo atomico) e gli elettroni disposti esternamente su anelli simili a quelli di Saturno. Furono però trovate diverse contraddizioni in questo modello, che finì presto per essere scartato.
Arriviamo
finalmente al 1909 e conosciamo i veri protagonisti di questo articolo: Ernest
Rutherford (vincitore del premio Nobel per la chimica l’anno precedente) era
nato in Nuova Zelanda, per poi prendere anche la cittadinanza britannica;
Johannes Wilhelm Geiger (quello del contatore Geiger per le radiazioni) era un
fisico tedesco; Ernest Mardsen, oltre ad avere lo stesso nome di battesimo di
Rutherford, aveva seguito rispetto a lui un percorso geografico inverso: nato e
laureato in fisica in Inghilterra, prese poi la cittadinanza neozelandese.
I tre si conobbero alla Victoria University di Manchester, dove Mardsen e
Geiger furono per alcuni anni assistenti di Rutherford. Il famoso esperimento (in
realtà erano più esperimenti, distribuiti durante più anni) di cui parleremo fu
materialmente eseguito dai due assistenti, ma è noto anche come esperimento di
Rutherford o esperimento della lamina d’oro.
 |
| Johannes Wilhelm Geiger a sinistra; Ernest Mardsen a destra |
Già, ma perché proprio l’oro?
Quello che Rutherford voleva fare era studiare come i raggi alfa, cioè particolari particelle con carica elettrica positiva, interagissero con la materia. Era allora necessario sparare queste particelle contro una lamina molto sottile, in modo che la sovrapposizione dei diversi strati di atomi interferisse il meno possibile con i risultati degli esperimenti: la grande malleabilità dell’oro lo rendeva un materiale perfetto per questo scopo. L’apparato sperimentale era quindi formato da una sorgente di raggi alfa e il bersaglio costituito dalla sottilissima lamina d’oro, il tutto circondato da uno “schermo” che permettesse di individuare dove le particelle finivano dopo aver incontrato la lamina.
Le leggi dell’elettromagnetismo ci insegnano che cariche opposte si attraggono, mentre cariche dello stesso segno si respingono. Essendo l’atomo, secondo il modello a panettone, un insieme abbastanza omogeneo di cariche positive e negative, le relativamente grosse particelle alfa non avrebbero dovuto subire deviazioni significative nell’attraversare la lamina, più o meno come una palla di cannone proseguirebbe pressoché indisturbata nell’attraversare uno strato di zucchero filato.
E invece no!
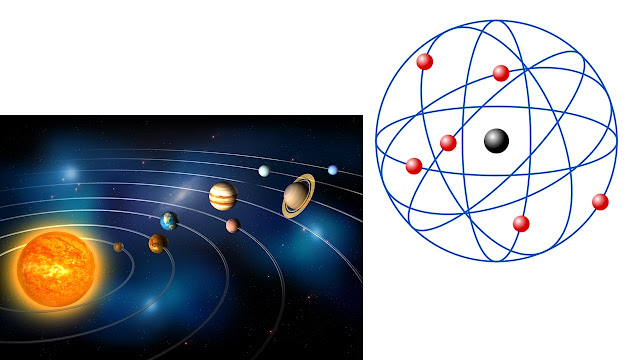
Tante particelle proseguivano effettivamente dritte (o quasi), ma un certo numero subiva deviazioni importanti e alcune addirittura rimbalzavano all’indietro, verso la sorgente che le aveva prodotte! Questi risultati erano evidentemente incompatibili con il modello di Thomson e la spiegazione fornita da Rutherford fu che la carica positiva (e sostanzialmente anche tutta la massa) dell’atomo si trovasse concentrata in una piccolissima zona centrale, detta nucleo, molto più piccola di quanto previsto dal modello saturniano di Nagaoka. In questo modo era possibile capire come le particelle venissero respinte all’indietro se “colpivano” il nucleo, deviate se ci passavano abbastanza vicino e come invece proseguissero indisturbate nel vuoto fra un nucleo e l’altro.
Il modello di Rutherford viene chiamato anche “planetario”, facendo corrispondere il nucleo atomico a una stella e gli elettroni ai pianeti che le orbitano attorno.
Giusto per
curiosità (poi prometto che non lo faro più! 😉), vorrei mettere qualche numero per rendere
l’idea delle effettive dimensioni di atomi e nuclei.
Il diametro
di un atomo è nell’ordine di 10-10 metri, ovvero un decimo di
milionesimo di millimetro: sono così piccoli che in un bicchiere d’acqua ce ne
stanno circa 10 000 000 000 000 000 000 000 000 (non state a contare gli zeri,
ve lo dico io, sono 25!).
E non finisce
qui: i nuclei hanno un diametro nell’ordine di 10-15 metri, cioè ben
100 000 volte più piccolo! In proporzione, se il nucleo fosse grande come una
mela, gli elettroni starebbero a quasi dieci chilometri di distanza. E in
mezzo? In mezzo non c’è nulla, siamo praticamente fatti di vuoto!
Però sappiamo benissimo di essere pesanti e, come abbiamo accennato poco fa, quasi tutto il nostro peso è concentrato nei minuscoli nuclei dei nostri atomi: se potessimo rimuovere gli elettroni e compattare i nuclei gli uni con gli altri, un bicchiere di questa materia nucleare peserebbe quanto un’intera montagna!
Le conseguenze di queste scoperte sono inimmaginabili: l’esistenza del nucleo atomico; la rappresentazione planetaria dell’atomo che usiamo ancora oggi; gli elettroni orbitanti intorno al nucleo, base per studiare i legami chimici fra atomi e molecole… però manca l’ultimo pezzo del puzzle per spiegare le osservazioni di padre Secchi che abbiamo visto la volta scorsa: prima di arrivare alla conclusione dovremo avere ancora un po’ di pazienza!
Ci risentiamo
al prossimo articolo.
Vi aspettRo!
Lorenzo
Bigazzi












Adesso guarderò i panettoni con occhi diversi..😊
RispondiEliminaAffascinante lo studio della materia e dei protagonisti che ci hanno consentito di conoscerla sempre più in dettaglio. Bello!! Complimenti
👍
Elimina